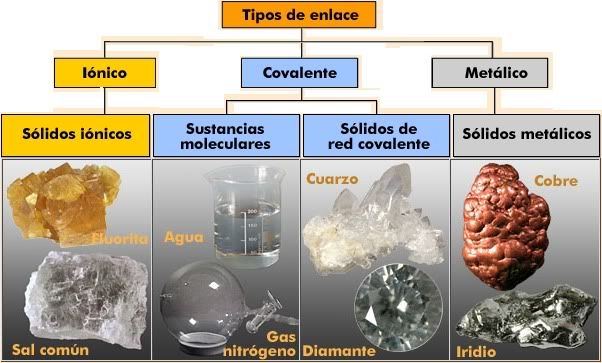
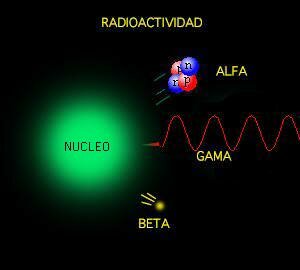
¿Qué son y dónde
están las radiaciones?
Las radiaciones son un tipo de energía que forma
parte de la naturaleza. Por ejemplo, gran parte del material del suelo es
uranio y las estrellas también emiten radiación, especialmente el sol. Además
de en el medio ambiente, también se encuentra en aplicaciones artificiales,
como la energía nuclear y ciertas aplicaciones médicas (radioterapia).
 |
| Radiación solar |
¿Cómo las absorbe
el cuerpo?
Hay muchos tipos
de partículas en las radiaciones, pero las que más abundan son las de tipo
gamma, que atraviesan sin dificultad los tejidos e impactan en el ADN de las
células, donde se pueden provocar mutaciones celulares y dar lugar a diversos
tipos de cáncer.
La radiación también se puede inhalar. Esta vía
tiene un agravante, porque el elemento químico entra en el cuerpo, puede
metabolizarse y permanecer durante mucho tiempo descargando radiaciones. El
plutonio, por ejemplo, se puede fijar en los huesos y los pulmones, llegando a
originar diferentes tumores.
 |
| Plutonio |
¿Qué riesgos
suponen para la salud?
La radiación controlada no representa ningún
riesgo. De hecho, las radiaciones conviven con nosotros, en hospitales, en
industrias, en ciertos gases. Además sirven para tratar el cáncer
(radioterapia) y para diagnosticar muchas enfermedades (radiografías).
Las repercusiones
dependen de la distancia a la que se encuentre cada persona, su sensibilidad
y, por supuesto, de las dosis y los materiales radiactivos emitidos.
 |
| Radiografías del cráneo, vistas anteroposterior y lateral |
¿Qué tipos de
efectos tiene la radiación en el organismo?
Hay que distinguir en primer
lugar entre la exposición puntual a altas dosis (100 milisieverts), que puede
provocar efectos agudos en poco tiempo (como malestar, quemaduras en la piel,
caída de pelo, diarreas, náuseas o vómitos), y los daños acumulados, que pueden
causar problemas de salud más graves a largo plazo (cáncer).
Estos efectos tienen que ver con
la capacidad de las radiaciones ionizantes para provocar cambios en la estructura de las
células, es decir, para alterar su ADN; algo que no ocurre
con las radiaciones no ionizantes (como las de infrarrojos).
¿Qué radiación
recibimos normalmente?
Según la Organización Mundial
de la Salud (OMS), una persona recibe unos 3
milisieverts a lo largo de todo el año,
el 80% a través de fuentes naturales de radiación (como ciertos gases que puede
haber en el terreno), y el otro 20% a través de procedimientos y pruebas
médicas.